EGFR Ex2O突變肺癌患者的免疫維持治療
病例資料
患者,男,58歲,因“咳嗽、咳痰1個多月”于2013-10-18就診。患者于2013年9月出現咳嗽、咳痰,痰白色黏稠,無痰血。入院后,完善相關檢查。2013-10-26胸部CT(圖1):右上肺后段分葉狀結節,首先考慮周圍型肺癌,建議結合穿刺活檢。縱隔及雙肺門未見明顯的腫大淋巴結。2013-10-29CT引導下穿刺活檢提示:(右肺上葉)非小細胞癌。支氣管鏡、腹部CT、骨ECT及顱腦MRI未見轉移病灶。腫瘤標志物、心肺功能未見異常。初步診斷:右肺上葉非小細胞癌,周圍型,cT1N0M0,IA期。
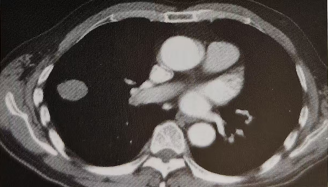
圖1.2013-10-26胸部增強CT可見右肺腫瘤
第一次MDT討論:患者早期肺癌,首次如何治療?
影像科:右肺上葉肺門旁可見一大小約2.8cm×2.6cm的分葉狀結節影,內密度大致均勻,增強后呈中等度強化,右肺上葉支氣管顯示狹窄閉塞,其外側見片狀模糊影,首先考慮右肺中央型肺癌伴右上肺阻塞性炎癥;右肺門數枚小淋巴結顯示,形態較飽滿。影像分期:T1cNOM0。
胸外科:該患者的臨床診斷為Ia期,若無心肺功能等特殊禁忌,首先選擇手術切除病灶。手術方式可選擇全麻胸腔鏡下右肺上葉切除術+肺門縱隔淋巴結清掃術。
放療科:除了手術以外,SBRT也是早期非小細胞肺癌的治療選擇。基于NCDB數據庫的大宗人群回顧性研究以及隨機對照研究(STARS/ROSEL)的分析結果提示SBRT不劣于手術治療:3年0S上,SABR優于手術(95%vs79%,P=0.037);3年RFS上,SABR與手術類似(86%vs80%,P=0.54);在毒性方面,SBRT低于手術。即使有這樣的結果,目前的NCCN指南仍然規定:除了做臨床試驗,不建議對早期可切除的NSCLC T1-2NOM0患者進SBRT。因此,目前對早期非小細胞肺癌使用SBRT的方法主要應用在那些存在手術禁忌的患者身上。而本案例中患者相對年輕,有良好的心肺功能,能夠承受肺葉切除加系統性淋巴結清掃,因此建議該患者接受肺癌根治手術,而不推薦進行立體定向放療。
治療情況
2013-11-06行剖右胸右肺上葉切除術+肺門縱隔淋巴結清掃術,手術及恢復過程順利。術后病理:右上肺葉低分化腺癌(瘤體2.6cm×2.4cm×2.0cm),未見脈管瘤栓及神經侵犯,癌轉移至(12組)0/3只、(11組)0/2只、(10組)2/6只、(7組)0/3只、(4R組)0/2只、(2組)0/3只淋巴結。免疫組化結果:TF-1(+),NapsinA(+),P63(-),P40(-),Ki-67(+),30%,CK7(+)。術后病理分期:pT1bN1M0,ⅡA期。
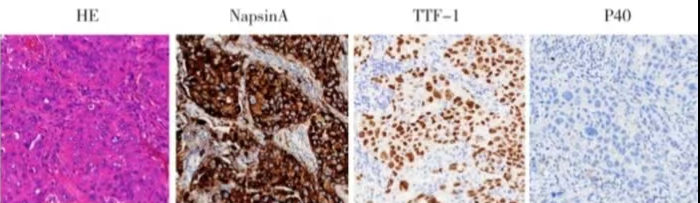
圖2.術后病理低分化腺癌
第二次MDT討論:患者術后選擇何種方式進行輔助治療?
腫瘤內科:根據肺癌根治術后的輔助治療,2008年LACE研究發現,術后輔助化療可以給患者帶來生存獲益,5年0S的絕對獲益率為5.49%。Ⅱ期和Ⅲ期患者有顯著的生存獲益,在亞組分析顯示,只有長春瑞濱與鉑類藥物聯合(NP方案)給患者帶來OS獲益。2019年ASCO會上,日本JIPANG研究探索了標準NP方案與目前針對非鱗非小細胞肺癌使用常見的培美曲塞聯合鉑類方案用于輔助化療的差異:培美曲塞/順鉑v長春瑞濱/順鉑,用于完全切除的Ⅱ-ⅢA期非鱗非小細胞肺癌輔助化療的隨機Ⅲ期臨床研究。雖然這項Ⅲ期臨床研究未達到終點,但是在NSCLC患者術后輔助化療中培美曲塞聯聯合順鉑和NP方案比具有相似的療效與更好的耐受性。在NCCN指南中ⅡB及以上分期均需術后輔助治療,方案推薦4周期含鉑雙藥方案,對于非鱗非小細胞肺癌首先推薦培美曲塞聯合順鉑,對于鱗癌首先推薦吉西他濱或多西他賽聯合順鉑。如果不能耐受順鉑,也可以選擇卡鉑。在IB-ⅡA期,具有高危因素的可考慮輔助治療。高危因素包括低分化腫瘤、血管侵犯、楔形切除、腫瘤>4cm、臟器胸膜累及和淋巴結狀態不明(Nx)。
放療科:該患者完成了剖右胸右肺上葉切除術+肺門縱隔淋巴結清掃術,切除了肺門、縱隔6站淋巴結,其中第10組淋巴結2顆陽性,縱隔2組淋巴結陰性,為R0切除術后,對于只存在肺門淋巴結轉移的患者是沒有必要進行術后輔助放療的。因為根據對ANITA研究的亞組分析顯示術后輔助放療對進行R0切除的術后病理為N1的患者的生存是有負面影響的,中位生存時間分別為觀察組的93.6個月s放療組的46.6個月。因此,對于這樣R0切除又經歷了肺門縱隔淋巴結清掃的非小細胞肺癌患者,不建議也不需要進行術后輔助放療。
治療情況
患者于2013-12-05至2014-02-10行4周期AP方案輔助化療:培美曲塞二鈉1g靜滴d1+順鉑45mg靜滴d1-3,Q3W。后患者定期復查。
患者于2018-11-14當地醫院復查胸部CT提示:縱隔多發淋巴結腫大,遂來院就診。2018-11-18支氣管鏡檢查:右上葉支氣管手術殘端未見新生物,第4組淋巴結EBUS-TBNA中找到非小細胞癌細胞。2018-11-25胸部強化CT示:右肺癌術后,縱隔內淋巴結(4R組)轉移,圖2。顱腦MRI、腫瘤標志物等檢查未見異常。目前診斷:右肺腺癌術后,縱隔淋巴結轉移,rTON2M0,ⅢA期。
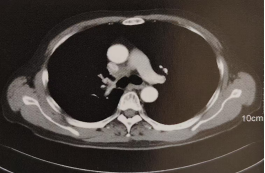
圖3.2018-11-20胸部增強CT縱隔4R區腫大淋巴結
第三次MDT討論:患者術后復發,如何進行下一步治療。
胸外科:右上肺癌術后,目前4R組淋巴結出現了復發,病理明確為非小細胞癌。患者此處的淋巴結復發,不排除初次手術清掃不徹底,如奇靜脈弓內側殘留部分淋巴結的可能性。患者目前的疾病處于區域復發狀態,根據NCCN指南,可以選擇手術切除及根治性放化療。此時,應首先判斷手術根治性切除的可能性。患者的右側胸腔及4織組淋巴結處經前次手術,目前的解剖結構已改變且極有可能存在明顯粘連,手術難度大:而且,CT提示4R組淋巴結與上腔靜脈之間的間隙不清,有可能已侵犯腔靜脈壁。以上兩者均提示手術根治性切除病灶的難度較大,存在無法RO切除的可能性。因此,建議患者首選放療。
腫瘤內科:患者術后出現縱隔淋巴結轉移,病理也進一步證實,如果能進一步免疫組化,可明確分型的具體類型。考慮患者目前仍處于局部復發,治療原則為根治性放化療。現在,PACIFIC研究證實對于Ⅲ期非小細胞肺癌患者放化療后可行Durvalumab免疫維持治療。JT0雜志公布了該研究的最新數據。數據顯示,免疫維持組vs觀察組的中位0S分別為47.5個月和29.1個月(HR=0.71),48個月的0S率分別為49.6%和36.3%,兩組的中位PFS分別為17.2個月和5.6個月(HR=0.55),48個月的PFS率分別為35.3%和19.5%。
放療科:該患者目前出現了縱隔4R區淋巴結腫大,對于這樣以往有肺癌病史并經過肺癌根治術的患者。該患者經氣管鏡下4R組淋巴結穿刺活檢后被確診為非小細胞肺癌,為右肺腺癌術后縱隔淋巴結轉移,分期為TON2M0,ⅢA期。雖然是屬于轉移,但是疾病仍然是區域性疾病,有根治的可能性,手術或者放療等局部治療是第一選擇。由于腫大淋巴結存在淋巴結包膜外侵犯,無法進行手術根治,同步放化療成為治療首選;放療的趨勢是選擇調強放療,針對縱隔內轉移淋巴結進行累及野照射,由于是腺癌,同步化療方案可以選擇等效低毒的培美曲塞+順鉑/卡鉑方案。
治療情況
2018-12-09至2019-01-23行同步放化療,GTV為縱隔內淋巴結(4R組)轉移病灶。CTV為縱隔2R區、縱隔4R區、右側支氣管殘端和右側肺門淋巴引流區,GTV均勻外放O.5cm而形成PGTV,CTV均勻外放0.5cm而形成PTV,PGTV劑量60Cy/30F/6w,PGTV劑54Gy/30F/6w。危及器官劑量有肺平均劑量:762cGy,V20=15%,V30=9%,脊髓Dmax=4070cGy,心臟V40=5%。 2018-12-09、2018-12-30、2019-01-21行同步化療3周期:培美曲塞0.9g靜滴d1+卡鉑600g靜滿d1,Q3W。放療后1個月復查胸部CT提示:淋巴結明顯縮小,見圖3,療效為PR。治療后進入門診隨訪。
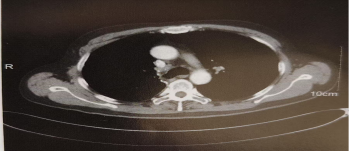
圖4.2019-02-06胸部增強CT縱隔4R區淋巴結縮小
2023年7月,患者于當地醫院復查胸部CT,結果提示兩肺及縱隔淋巴結轉移,遂至我院就診。2023-07-15胸部增強CT示(圖4):兩肺有多枚小結節,右肺明顯,考慮轉移;雙側鎖骨區結節,縱隔內有數枚淋巴結影,考慮轉移。2023-07-18右側鎖骨上窩淋巴結穿刺活檢病理示:(右鎖骨上結)纖維組織內轉移或浸潤性低分化癌,分子檢測結果:EGFR基因(ARMS法)(腫瘤樣本中檢測到EGFR Ex20ins突變。免疫組化:ALK(D5F3)(-)、P40(-)、TTF-1(+)。顱腦MR1、腫瘤標志物等其余檢查未見明顯異常。目前診斷:右肺腺癌術后,兩肺轉移、縱隔及鎖骨上淋巴結轉移,rTON3M1a,IVA期,EGFR Ex20ims突變。
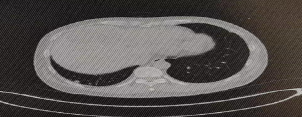
圖5.2023-07-15胸部CT可見肺內轉移瘤
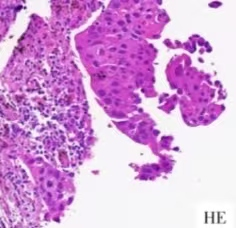
圖6.鎖骨上淋巴結穿刺活檢病理
第四次MDT討論:患者腫瘤出現遠處轉移,下一步該如何治療?
影像科:右肺癌術后縱隔淋巴結轉移經放療后復查雙肺胸膜下新出多枚細小結節,結清;縱隔1區及2R區有多枚增大的淋巴結影,較前新出;結合病史,均考慮轉移所致的可能性大。
腫瘤內科:在肺癌靶點突變中最常見的一類基因突變類型是EGFR。中國非小細胞肺癌患者的突變率為35%-40%,常見突變位點發生在18、19、20和21號外顯子上。其中,19號外顯子缺失突變占45%,21號外顯子L858R點突變占40%-45%,這兩種突變為常見突變。除19與21號外顯子外,在EGFR突變中有一種亞型,被稱為EGFR Ex220插入突變(EGFR Ex20ims),在EGFR突變中占4%-10%。此類患者使用傳統的一代、二代EGFR-TKI的療效均不理想,導致預后比較差。在中國,目前還沒有針對EGFR Ex220ins的靶向藥物上市,所以當前針對EGFR Ex20is突變的患者,一線治療上還是首選化療治療。通常選擇培美曲塞聯合鉑類化療,或者化療聯合抗血管生成靶向藥貝伐珠單抗(也屬于常用方案)。
治療情況
2023-08-01至2023-08-22予以行AC+貝伐珠單抗方案治療2周期:培美曲塞0.9g靜滴d1+卡鉑500mg靜滴d1+貝伐珠單抗600mg靜滴d1,Q3W。兩次化療加抗血管治療后2023-09-13胸部CT示(圖5):兩肺轉移瘤增多、增大。療效評價:PD。患者在接受化療之后,體力情況下降,S-2,右側鎖骨上淋巴結仍腫大,大小質地同前。2023-09-15對鎖骨上淋巴結穿刺活檢組織行PD-L1表達(2C3抗體)檢測,示:TPS=80%。
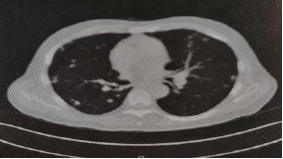
圖7.2023-09-13胸部CT可見肺內多發轉移瘤
第五次MDT討論:患者腫瘤經系統化療再次進展,下一步如何治療。
病理科:將肺癌的PD-L1免疫組化應用TPS進行評估。TPS應對切片內所有的腫瘤細胞進行陽性率評估,陽性的腫瘤細胞應表現為線性的、可靠的細胞膜著色(胞漿可著色,可不著色)。其余的細胞,主要是炎癥細胞和腫瘤間質細胞、血管內皮細胞等,即使為陽性,也不能被記入陽性細胞。因此,對于肺癌PD-L1陽性率的評估,除了對免疫組化片進行定量計數外,同時應結合HE形態,對無效細胞進行甄別。本例的腫瘤細胞著色清晰而明顯,背景上的炎癥細胞以及間質細胞基本為陰性,干擾較弱。本例的腫瘤細胞PD-L1的陽性率較高(>50%,應被當做PD-L1高表達的病例,患者后期在免疫治療中獲益的可能性較高。
腫瘤內科:化療聯合抗血管治療的療效不佳,并且出現了體力評分的下降,淋巴結穿刺PD-L1(22C3)提示患者屬于免疫高表達人群。EGFR基因是免疫單藥治療的負性因子,免疫治療的療效不佳,但考慮該患者有EGFR耐藥突變,目前這類患者能進行免疫治療的獲益數據并不多。在2018年,免疫PD-1藥物已經在國內上市,考慮患者有多線化療耐藥,結合PD-L1TPS≥50%,可考慮免疫治療。
治療情況2023-09-28開始予以帕博利珠單抗200mg靜滴Q3W治療。用藥后,患者的體力狀況逐漸得到改善,PS=0。定期進行復查,胸部CT提示雙肺結節及淋巴結未見增大。療效評價SD。無不良反應。根據隨訪,患者于2024年10月死于非腫瘤事件。
總結
該患者是一例EGFR Exa20ims突變患者。這是EGFR-TKI耐藥突變,但同時該患者有PD-L1免疫高表達。既往的研究均顯示EGFR敏感突變患者的PD-1/-PD-L1抑制劑的療效不佳且易出現超進展,因此,大多數的免疫藥物研究中均排除了EGFR敏感突變的人群,僅IMPOWER150研究中顯示EGFR/ALK突變患者在化療聯合貝伐珠單抗和免疫的四藥聯合方案中有獲益,但大部分也是TKI耐藥后的患者。但臨床中有部分為EGFR耐藥突變的患者,如EGFR Ex2Ois,這部分人群的靶向治療的療效有限,免疫治療是否有獲益也是值得探索的。所以,對于攜帶EGFR Exz20ins的患者,由于其較高的PD-L1表達,這部分患者可能從兔疫治療中獲益,但仍需更多的研究數據來證實。
本站所注明來源為"愛愛醫"的文章,版權歸作者與本站共同所有,非經授權不得轉載。
本站所有轉載文章系出于傳遞更多信息之目的,且明確注明來源和作者,不希望被轉載的媒體或個人可與我們
聯系zlzs@120.net,我們將立即進行刪除處理
熱點圖文
-
雙側雙原發肺癌患者綜合治療
多原發肺癌(MPLC)是指同一個體,一側或雙側肺內不同的部位,同時或先后發...[詳細]
-
腦部寡轉移肺癌患者的外科治療
目前,針對寡轉移病灶手術切除的研究較多,而在同一情況下涉及原發病灶手術切除...[詳細]

