晶格放射治療有效治療大塊肺肉瘤樣癌1例
在姑息治療方面對于無法切除的大塊腫瘤的管理一直是一個難題。晚期癌癥患者由于腫瘤造成的器官壓迫和浸潤,因此承受著巨大的痛苦。患者通常身體比較虛弱,因此治療策略應(yīng)盡可能保守,主要以緩解癥狀、提高生活質(zhì)量以及避免過度毒性為主[1]。
考慮到全身治療聯(lián)合常規(guī)放療在巨大腫瘤患者中的效果不佳,體部立體定向放療(stereotactic body radiotherapy,SBRT)是一種可以嘗試的新選擇。然而,SBRT通常在1-5次分割中給予高劑量,僅用于較小的病變(最大直徑 5 厘米),以避免嚴(yán)重毒性反應(yīng)[2]。標(biāo)準(zhǔn)的姑息性照射采用低劑量即 20 Gy/5 次分割或 30 Gy/10 次分割,無法對大腫瘤實現(xiàn)令人滿意的控制。在此背景下,晶格放射治療(Lattice radiation therapy,LRT)可能是一種很有前景的策略,通過給予極高劑量的輻射來提高療效,同時不會增加危及器官(organs at risk,OAR)的毒性。
LRT 是一種空間分割放射治療(SFRT)技術(shù),其基于在靶區(qū)形成非均勻劑量分布同時保護(hù)危及器官[3]。它由二維網(wǎng)格治療的三維體積配置構(gòu)成,基于在靶區(qū)病灶內(nèi)部創(chuàng)建的三維陣列。該陣列存在高劑量區(qū)域,稱為“峰”劑量,其間由周邊低劑量區(qū)域即“谷”劑量隔開[4,5]。該技術(shù)能夠給予腫瘤消融劑量,增加了腫瘤縮小的概率,并帶來持久的療效。此外,治療腫瘤體積內(nèi)產(chǎn)生的不均勻劑量梯度可能改善免疫系統(tǒng)對未受照射部位腫瘤細(xì)胞的應(yīng)答[6,7]。下文我們展示了1例LRT治療不可切除肺肉瘤樣癌案例,并對其進(jìn)行了討論。
病例報告
患者男,69歲,2023 年 5 月因骶骨疼痛和呼吸困難入院。入院后行胸部CT檢查發(fā)現(xiàn)骶髂關(guān)節(jié)3.8 cm×3.8 cm腫物以及肺部大腫塊,直徑11 cm×12 cm,該腫塊環(huán)繞并明顯壓迫左主支氣管,雙側(cè)肺門和縱隔多處腫大淋巴結(jié),見圖1。后行支氣管內(nèi)超聲引導(dǎo)下經(jīng)支氣管針吸活檢(EBUS-TBNA)獲取病理組織用于細(xì)胞學(xué)、免疫組化和腫瘤比例評分(TPS)檢測。病理結(jié)果為肺肉瘤樣癌,免疫組化結(jié)果:CK-Pan(+),EMA(+),TTF-1(-),NapsinA(-),P40(-),Bcl-2(-),CD34 (-) , WT1(-), CK5/6(-),Calretinin(-),MC(-),CK19 (+).PD-L1 TPS>50%。腫瘤分期為cT4N3M1c,IV 期。
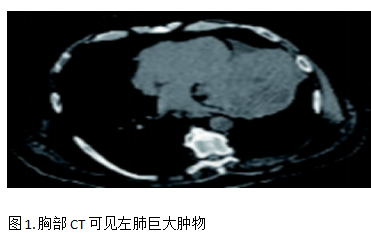
為了緩解骶骨疼痛,骶骨接受姑息性放療,劑量為20Gy/5次,止痛效果良好且病灶穩(wěn)定。2023年5月-10月完成6個周期的卡鉑+紫杉醇化療。2023年12月復(fù)查胸部CT發(fā)現(xiàn)原發(fā)灶和縱隔淋巴結(jié)進(jìn)展(PD),二線治療方案改用納武利尤單抗免疫治療,2024年1月-3月完成6個周期免疫治療,2024年4月復(fù)查胸部CT發(fā)現(xiàn)疾病再次進(jìn)展(PD),見圖2。
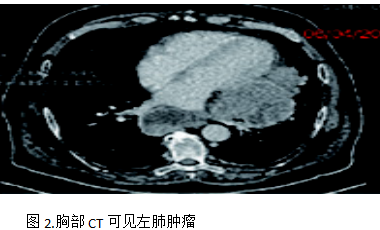
病人開始三線治療,2024年4月-9月完成6周期吉西他濱聯(lián)合卡鉑化療。后患者出現(xiàn)呼吸困難加重,ECOG 2 分,于2024 年 9 月復(fù)查胸部CT,顯示肺部腫瘤直徑19 cm×16 cm,疾病進(jìn)一步進(jìn)展(PD)。
考慮到腫瘤巨大,經(jīng)MDT討論后采用LRT而非標(biāo)準(zhǔn)姑息性放療,并經(jīng)過患者同意。2024年9月10日至20日,患者接受了LRT治療,在腫瘤內(nèi)部頂點劑量給予55Gy/5次,病灶周邊劑量為20Gy/5次。
患者定位時,使用體膜固定,大孔徑CT掃描,層厚3mm。從定位CT采集到首次治療的時間間隔為3天。在放療計劃制定方面,我們使用Eclipse 15.6版計劃系統(tǒng)(TPS)以及 AAA 算法。能量選用6MV無均整濾過器的X射線,適形調(diào)強放療技術(shù)(IMRT)進(jìn)行計劃設(shè)計,共應(yīng)用13個射野,應(yīng)用Varian直線加速器IX進(jìn)行圖像引導(dǎo)(IGRT)照射,1次/日,共5次。每天通過錐形束CT對患者的擺位進(jìn)行驗證。患者在治療床上的平均時間為 20 分鐘。
參照Lattice框架,在軸向平面內(nèi)頂點間距為3cm,正交軸上頂點中心到中心的距離為6cm(邊到邊距離為4.5cm),沿對角線軸的距離為 3√2 cm(空間距離)。我們參考了S.Luis 的經(jīng)驗,并按照 LITE SABR M1 試驗中的方式放置頂點[8]。GTV是指影像學(xué)可見腫瘤及轉(zhuǎn)移淋巴結(jié)。在創(chuàng)建晶格框架時,頂點必須距離任何危及器官(OARs)至少1.5厘米。我們在腫瘤內(nèi)生成17個頂點(頂點直徑=1.5 厘米),總體積為 26.5 cc。考慮到器官運動或擺位誤差導(dǎo)致患者的位置變化,在GTV外側(cè)各向外擴8mm生成計劃靶區(qū)(PTV)。處方劑量給予95% PTV劑量20Gy/5次,同時17個頂點劑量同步增強,在頂點區(qū)域?qū)崿F(xiàn)55Gy/5次高劑量,見圖3,危及器官受量如下,雙肺:V5=77.6%、V10=18.7%、V20=1.3%、Dmean =9.1 Gy;心臟:V5= 99.8%、 V10=77.9%、V20 =12.6%、Dmean=14 Gy;脊髓:Dmax =16.9 Gy;食管:Dmean=10.6 Gy; Dmax=24.9 Gy。
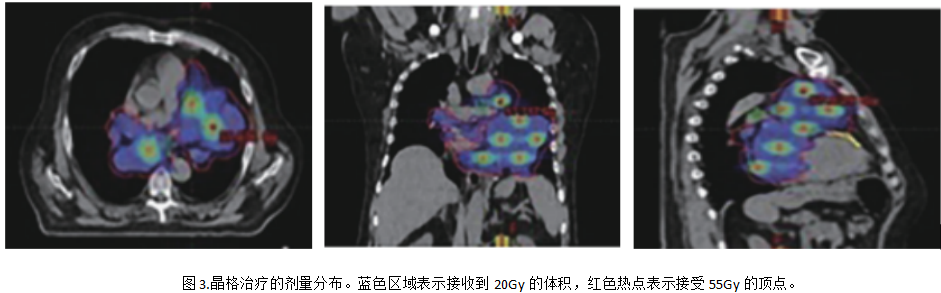
LRT治療期間未使用化療藥物,期間患者出現(xiàn)1級乏力和1級食管炎,經(jīng)對癥治療后緩解。LRT結(jié)束后,四線治療給與長春瑞濱單藥化療。
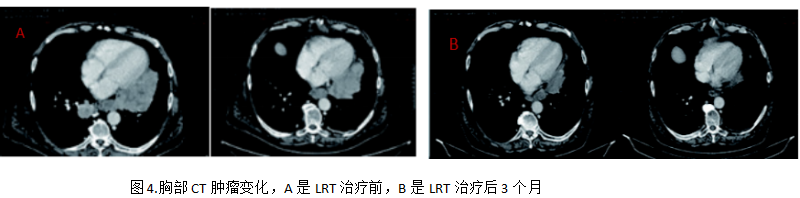
LRT治療后前1個月,每周進(jìn)行評估1次,后2個月每月接受一次評估,未報告有不良反應(yīng)。2025年1月在LRT治療后3個月時復(fù)查胸部 CT 顯示原發(fā)灶(直徑 8 厘米×4 厘米)和縱隔淋巴結(jié)出現(xiàn)了顯著縮小,見圖4。患者ECOG 評分1分,日常生活有了顯著改善。截至 2025年4月15日的最后一次隨訪,ECOG1分,LRT治療6 個月后復(fù)查胸部CT證實疾病穩(wěn)定,肺部病灶的緩解狀態(tài)得以持續(xù)。患者仍在繼續(xù)使用長春瑞濱治療。
討論
體積較大的腫瘤往往具有異常的血管,內(nèi)部存在壞死和缺氧區(qū)域。化療藥物無法在腫瘤內(nèi)部達(dá)到足夠的血藥濃度,因而會大大降低化療的效果。此外,這種大塊腫瘤具有典型的免疫抑制微環(huán)境,降低機體的免疫系統(tǒng)活性,從而削弱免疫治療的療效[9,10]。盡管姑息性放療是一種比較合適的選擇,但面對體積較大的腫瘤,由于其大小及乏氧環(huán)境進(jìn)而對放療產(chǎn)生抵抗性。而且使用標(biāo)準(zhǔn)姑息放療方案在不造成無法接受的毒性風(fēng)險情況下難以達(dá)到有效的高劑量。這種以提高患者生活質(zhì)量及控制癥狀為目的姑息治療效果有限[11]。LRT能夠在腫瘤內(nèi)部給予高劑量同時在腫瘤周邊保持較低劑量,并有可能在可接受的毒性范圍內(nèi)實現(xiàn)腫瘤緩解。
有關(guān)LRT的研究介紹
盡管LRT具有治療潛力,但目前關(guān)于治療計劃和患者預(yù)后的相關(guān)數(shù)據(jù)較少。此外,許多現(xiàn)有病例多采用的是混合或非單純純LRT方法[12,13]。例如,Amendola 等人報道了一組關(guān)于非小細(xì)胞肺癌(NSCLC)的 LRT治療病例,腫瘤體積縮小約 40%。然而,他們采用的是混合方法,首次LRT治療(頂點 18 Gy,周邊 3 Gy)之后進(jìn)行了常規(guī)放療(25/33 次,每次1.8-2 Gy)[12]。在另一組 IIIB - IVA 期巨大宮頸癌病例中也采用了類似的混合 LRT方法,患者先接受了LTR(頂點 24 Gy,周邊9 Gy,分 3 次),隨后進(jìn)行了常規(guī)放療(39.60 - 45.00 Gy,每次1.8 Gy)[13]。人們比較擔(dān)心在進(jìn)行適當(dāng)?shù)?/span>LRT治療時(即多分次)可能會導(dǎo)致放療劑量過高,這可能是LRT臨床文獻(xiàn)匱乏的一個原因。然而,值得注意的是,最近發(fā)表的“LITE SABR M1 一期試驗”[8]首次證實了LRT的安全性。在本研究中,20 例有巨大病灶的腫瘤患者接受了LRT治療,頂點劑量為 66.70 Gy,病灶周邊劑量為 20 Gy,分 5 次給予(每次分別為 13.34 Gy 和 4 Gy)。
本案例應(yīng)用LRT效果顯著及背后機制
為了安全起見,該病例我們謹(jǐn)慎地將頂點劑量限制在55Gy(每次11Gy),周邊劑量限制在20 Gy(每次4Gy)。該腫瘤除了發(fā)生顯著的縮小外,病人還有較好的生活質(zhì)量的改善。LRT除了能夠克服腫瘤細(xì)胞放射性抵抗外,一些研究還表明,LRT可能會引發(fā)腫瘤細(xì)胞的免疫原性死亡,釋放出許多“損傷相關(guān)分子模式(damage associated molecular patterns,DAMPs)”,從而啟動并顯著增強機體免疫系統(tǒng)的反應(yīng)[14,15]。因此,由于劑量分布不均,LRT可能同時具有消融作用(局部作用)和免疫調(diào)節(jié)作用(遠(yuǎn)位效應(yīng))[16]。因此,LRT高劑量可以明顯緩解腫瘤負(fù)荷外,還能夠重塑免疫抑制的腫瘤微環(huán)境,使其更具免疫原性,從而在照射部位(旁觀者效應(yīng))和遠(yuǎn)處部位(遠(yuǎn)位效應(yīng))啟動抗腫瘤免疫反應(yīng)[17]。
該案例的局限性
鑒于此,盡管有關(guān)LRT免疫調(diào)節(jié)作用的數(shù)據(jù)尚處于初步探索階段,且必須進(jìn)行進(jìn)一步的研究。盡管腫瘤反應(yīng)顯著,但我們的報告中存在兩個局限性。首先,這是一份關(guān)于單純LRT治療的病例報告,其主要目的是緩解癥狀,而未對LRT對機體免疫系統(tǒng)的作用進(jìn)行研究。其次,盡管LRT急性期的毒性較低,但目前由于隨訪時間太短,尚無該患者LRT慢性毒性的相關(guān)數(shù)據(jù)。
結(jié)論
LRT可能是一種非常有效的放療策略,能夠獲得具有臨床意義的腫瘤反應(yīng),從而改善患者的生活質(zhì)量,且不會引起治療相關(guān)的毒性。本病例報告提供了LRT在大塊腫瘤管理中的臨床價值。目前尚無數(shù)據(jù)表明單純 LRT與混合LRT哪種策略更優(yōu)。因此,所有LRT方法都應(yīng)積極加以研究。
參考文獻(xiàn)
1.Jiang L, Li X, Zhang J, et al. Combined High-Dose LATTICE Radiation Therapy and Immune Checkpoint Blockade for Advanced Bulky Tumors: The Concept and a Case Report[J]. Front Oncol. 2021,10(17):548132-548140.
2.Boyce-Fappiano D, Damron EP, Farooqi A, et al. Hypofractionated Radiation Therapy for Unresectable or Metastatic Sarcoma Lesions[J]. Adv Radiat.Oncol.2022,7(2):100913-100920.
3.Duriseti S, Kavanaugh J, Goddu S, et al. Spatially fractionated stereotactic body radiation therapy (Lattice)for large tumors[J]. Adv Radiat Oncol.2021,6(5):100639-100645.
4.Wu X, Perez NC, Zheng Y, et al. The Technical and Clinical Implementation of LATTICE Radiation Therapy (LRT)[J]. Radiat Res. 2020,194(9):737-746.
5.Asur R, Butterworth KT, Penagaricano JA, et al. High dose bystander effects in spatially fractionated radiation therapy[J]. Cancer Lett. 2015,356(6):52-57.
6.Kumari S, Mukherjee S, Sinha D, et al.Immunomodulatory Effects of Radiotherapy[J].Int J Mol Sci. 2020,21(4):8151-8158.
7.Li X, Wu D, Liu H, et al.Pulmonary sarcomatoid carcinoma: progress, treatment and expectations[J].Ther Adv Med Oncol.2020,12(14):175-182.
8.Duriseti S, Kavanaugh JA, Szymanski J, et al. LITE SABR M1: A phase I trial of Lattice stereotactic body radiotherapy for large tumors[J]. Radiother Oncol.2022,167(6):317-322.
9.Karsch-Bluman A, Feiglin A, Arbib E, et al. Tissue necrosis and its role in cancer progression[J].Oncogene.2019,38(11):1920-1935.
10. Hinshaw DC, Shevde LA. The Tumor Microenvironment Innately Modulates Cancer Progression[J].Cancer Res.2019,79(8):4557-4566.
11. O'Donovan A, Morris L. Palliative Radiation Therapy in older Adults With Cancer: Age-Related Considerations[J].Clin Oncol (R Coll Radiol).2020,32(5):766-774.
12. Amendola BE, Perez NC, Wu X, et al. Safety and Efficacy of Lattice Radiotherapy in Voluminous Non-small Cell Lung Cancer[J].Cureus.2019,11(13):4263-4270.
13. Amendola BE, Perez NC, Mayr NA, et al. Spatially Fractionated Radiation Therapy Using Lattice Radiation in Far-advanced Bulky Cervical Cancer: A Clinical and Molecular Imaging and Outcome Study[J]. Radiat Res.2020,194(8):724-736.
14. Kanagavelu S, Gupta S, Wu X, et al. In vivo effects of lattice radiation therapy on local and distant lung cancer: potential role of immunomodulation[J]. Radiat Res. 2014,182(11):149-162.
15. Jarosz-Biej M, Smolarczyk R, Cichoń T, et al. Tumor Microenvironment as A "Game Changer" in Cancer Radiotherapy[J]. Int J Mol Sci. 2019,20(7):3212-3220.
16. Ferini G, Valenti V, Tripoli A, et al. Lattice or Oxygen-Guided Radiotherapy: What If They Converge? Possible Future Directions in the Era of Immunotherapy[J]. Cancers (Basel). 2021,13(6):3290-3298.
17. Cytlak UM, Dyer DP, Honeychurch J, et al.Immunomodulation by radiotherapy in tumour control and normal tissue toxicity[J]. Nat Rev Immunol.2022,22(4):124-138.
本站所注明來源為"愛愛醫(yī)"的文章,版權(quán)歸作者與本站共同所有,非經(jīng)授權(quán)不得轉(zhuǎn)載。
本站所有轉(zhuǎn)載文章系出于傳遞更多信息之目的,且明確注明來源和作者,不希望被轉(zhuǎn)載的媒體或個人可與我們
聯(lián)系zlzs@120.net,我們將立即進(jìn)行刪除處理
熱點圖文
-
晶格放射治療有效治療大塊肺肉瘤樣癌1例
在姑息治療方面對于無法切除的大塊腫瘤的管理一直是一個難題。晚期癌癥患者由于...[詳細(xì)]
-
多參數(shù)MRI在前列腺癌精準(zhǔn)診斷應(yīng)用思考
隨著前列腺癌發(fā)病率的逐年上升,精準(zhǔn)診斷與分層治療成為改善患者預(yù)后的關(guān)鍵。多...[詳細(xì)]

